|
Меню сайта
|
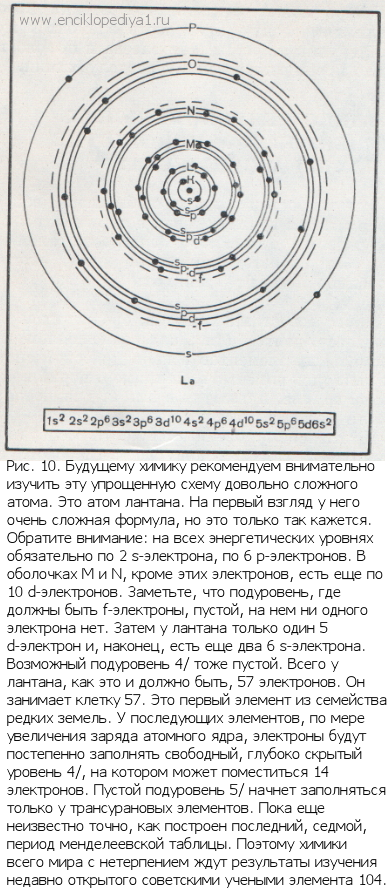
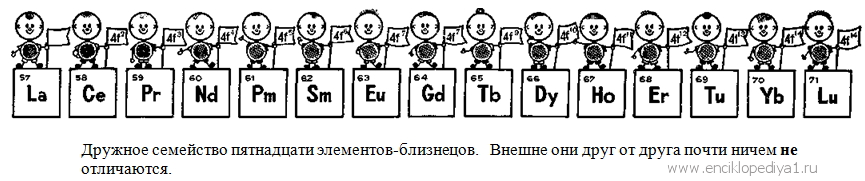
Сколько редкоземельных элементов в одной клетке табл. Менделеева?Сколько редкоземельных элементов в одной клетке табл. Менделеева?В этом простом и, казалось бы, ясном вопросе отражается почти вековая история ошибок и заблуждений. Для самого Менделеева такой вопрос был просто неуместен: одну клетку в таблице может занимать только один элемент. Много известных химиков, среди них и сам Менделеев, долго бились над размещением редкоземельных элементов в периодической системе: пытались поместить, например, церий в четвертой группе, празеодим в пятой, для неодима искали место в шестой. Но эти необыкновенные элементы бесцеремонно нарушали самую основу периодического закона. При любых попытках разместить их в таблице периодическая повторяемость свойств не соблюдалась. В главных и побочных подгруппах должны быть сходные элементы. Церий жене имел ничего общего с цирконием, празеодим с ниобием, а неодим совершенно не был похож на молибден. Зато, по мере того как изучались их химические свойства, становилось все более ясным, что эти элементы сходны друг с другом, как братья-близнецы. Они настолько химически подобны, что химику их и различить и разделить чрезвычайно трудно. Но все они, бесспорно, разные элементы. В этом химики не сомневались. Друг Менделеева, чешский химик Браунер, предложил самое простое решение: поместить их все в одну клетку таблицы. Менделееву пришлось с этим согласиться. Но, по существу, это только увеличило принципиальную трудность проблемы, не разрешив ее. Если одно место могут занимать несколько различных элементов, то, во-первых, нарушается основной принцип периодической системы и, во-вторых, становится совершенно невозможным предвидеть и предсказать, сколько же их можно найти в природе, сколько их вообще может существовать. Химики же всего мира разыскивали их очень усердно и более чем успешно. За короткий период, примерно за 30 лет, было «открыто» почти сто (!) редкоземельных элементов. Все попытки найти разумное решение проблемы редких земель были безуспешными. Она казалась неразрешимой. Только квантовая теория строения атома помогла решить окончательно эту большую загадку химии. Детальное изучение спектральных характеристик у редкоземельных элементов показало, что строение их атомов очень своеобразно. Все они «внешне» совершенно сходны между собой. Их наружные электронные оболочки, у всех без исключения, построены совершенно одинаково (рис. 10). У всех у них в самой наружной Р-оболочке по два s-электрона, поэтому все они — металлы. Глубже расположенный d-подуровень, принадлежащий к O-оболочке, в атомах редкоземельных элементов еще не заполнен — в нем всего лишь один электрон, который тоже может принимать участие в химических превращениях. Поэтому редкоземельные элементы преимущественно трехвалентны. Но это разные элементы, заряды их атомов различны, и потому у них должно быть различным и число электронов. Определение порядкового номера установило, сколько же всего этих элементов, а изучение спектров помогло выяснить их строение. Оказалось, что они отличаются друг от друга числом f-электронов на оставшейся незаполненной, глубоко скрытой в недрах атома N-оболочке. Эти электроны защищены снаружи «броней» устойчивой оболочки 5s25p6, той самой, которая обеспечивает благородному газу ксенону (элемент 54) его свойства. Эти электроны почти совершенно блокированы и не могут проявлять себя в химических свойствах. Правда, не все ученые с этим согласны. Многие считают, что строение редкоземельных элементов значительно сложнее: 5d-электрон, утверждают они, есть только у лантана, гадолиния и лютеция, у остальных лантаноидов на 4f-уровне на один электрон больше. Изучение лантаноидов еще не завершено до конца. Зная теперь законы построения внешних электронных оболочек атома, любой из вас, будущих химиков, сможет сам решить проблему, над которой химики прошлого бились более 160 лет, считая с открытия первой «редкой земли»,— сколько редкоземельных элементов существует в природе. Очевидно, ровно столько, сколько их соответствует постепенному заполнению всех орбит с этими электронами. Обозначение f заменяет квантовое число l=3. Мы уже знаем, что таких орбит может быть 2x3+1=7. А на каждой может быть не больше двух электронов. Следовательно, таких элементов в природе может быть четырнадцать. Всего же в природе должно существовать ровно пятнадцать элементов-близнецов, . считая и лантан, свойствами близкий к лантаноидам. Столько их в действительности и оказалось: начиная с 57-го — лантана до 71-го — лютеция. Правда, в природе все-таки оказался пробел: 61-го элемента найти пока не удалось. Пришлось ученым самим его изготовить. Его назвали прометием. Итак, можно ли сказать, что в одной клетке периодической таблицы размещаются пятнадцать элементов? Этот вопрос обсуждается часто и в наши дни. Периодический закон Менделеева — это всеобщий закон природы. В естественной системе элементов каждый элемент занимает одно место, и, следовательно, в таблице каждый элемент — одну клетку. Менделеев придал своей таблице самую простую и удобную форму. Изображать же ее можно по-разному. Можно просто помнить, что одна клетка между барием и гафнием условно заменяет сразу 15 клеток. Но можно менделеевскую таблицу начертить так, чтобы все длинные периоды оказались развернутыми. Периодический закон от этого не изменится и не пострадает. |
ПОИСК
Block title
|