|
Меню сайта
|
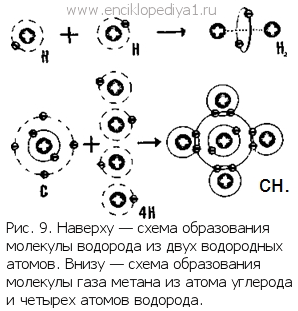
Строение атома и химияСтроение атома и химияВ атоме первого элемента таблицы Менделеева — водорода только один s-электрон. Немногие вещества обладают такой химической активностью, как атомарный водород. Именно благодаря примеси свободных атомов водород в момент выделения из связывающих его соединений (in statu nascendi, как говорили еще древние алхимики) обладает удивительной способностью к самым разнообразным химическим превращениям. Сосед водорода по таблице — гелий. В его атоме на одной орбите два s-электрона. Обратите внимание на то, что оба эти электрона, образующие гелиевую орбиту,— спаренные. Они вращаются в разные стороны, каждый вокруг своей оси. Два таких электрона и придают несокрушимую прочность атому гелия. Два атома водорода соединяются в одну молекулу, и при этом в очень прочную молекулу. За счет пары электронов эти атомы образуют гелиеподобную, общую для обоих атомов, орбиту (рис. 9). Гелий, как и другие благородные газы, в атомах которых все электроны спаренные, почти не способен образовывать молекулы. В свободном газообразном состоянии он существует в виде отдельных атомов. Запомните эту очень важную и удивительную способность двух s-электронов образовывать общую очень прочную орбиту. Это может происходить, даже если оба электрона принадлежат двум разным атомам. Такое свойство электронов имеет особенно большое значение для химии. Именно благодаря этому и могут возникать очень прочные связи между атомами, могут образовываться и существовать молекулы. Химики такую химическую связь называют гомеополярной. Насколько важны для химии внешние электроны атома, можно судить хотя бы по тому, что именно их число и определяет валентность элемента . У лития, натрия, калия — одновалентных элементов — на внешней орбите атомов по одному s-электрону. Бериллий, магний, кальций потому и двухвалентны, что на их внешних орбитах по два s-электрона. Элементы неон, аргон, криптон, ксенон обладают одинаково построенными наружными электронными оболочками из восьми электронов s2p6. Эти оболочки очень прочны. Атомы благородных газов, стоящих в нулевой группе периодической таблицы, держат свои электроны очень крепко. Если атомы металлов калия, кальция, алюминия и других элементов, стоящих в первых группах таблицы, потеряют свои слабо связанные наружные электроны, то их электронные оболочки станут такими же, как оболочки атомов ближайших благородных газов, стоящих перед ними в таблице. У элементов, например, седьмой группы во внешней электронной оболочке по семь электронов. Если такой атом захватит еще один электрон, то его наружная электронная оболочка станет такой же, как у ближайшего следующего за ним в таблице элемента нулевой группы. При химических реакциях происходит перераспределение наружных электронов: электронные оболочки стремятся стать такими же, как у ближайших благородных газов. Тот из атомов, который отдает электрон, становится заряженным положительно, атом же, захвативший электрон, будет заряжен отрицательно. Разноименно заряженные атомы начнут благодаря силам электростатического взаимодействия притягиваться друг к другу. Так возникает еще один тип химической связи. Химики ее называют гетерополярной. Таким образом, силы, связывающие атомы в молекулы, возникают в результате взаимодействия положительных ядер и отрицательных электронных оболочек атомов. Это взаимодействие всегда стремится так перестроить внешнюю электронную оболочку, чтобы она стала наиболее прочной, наиболее устойчивой, такой же, как у ближайшего элемента нулевой группы. Рассмотрите внимательно простую химическую реакцию, записанную в не совсем обычной для школьного учебника форме:
и сравните результат с формулой электронной оболочки благородного газа неона
|
ПОИСК
Block title
|