|
Меню сайта
|
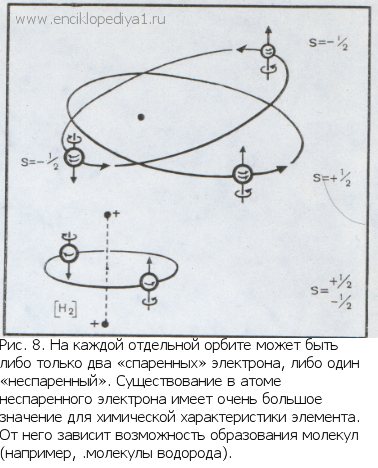
Число электронов на орбите зависит от спинового квантового числаЧисло электронов на орбите зависит от спинового квантового числаПоведение атомов в сильных неоднородных магнитных полях показало, что каждый электрон в атоме ведет себя как магнитик. А это указывает на то, что электрон вращается вокруг своей собственной оси, словно планета на орбите. Это свойство электрона получило образное название «спин» (английское слово «спин», по-русски — «прясть», «вращать»). В отличие от вращения обычных тел в нашем микромире, где возможны любые скорости вращения, вращательное движение электрона постоянно и неизменно. Это его неотъемлемое свойство. Вращение электрона совершенно необычно: ни замедлить, ни ускорить, ни остановить его нельзя. Оно одинаково для всех электронов в мире. Но хотя спин — общее свойство всех электронов, в нем причина различия между электронами в атоме. Два электрона, вращаясь на одной и той же орбите вокруг ядра, обладают одним и тем же спином, и все же они могут различаться направлением собственного вращения. При этом изменяется знак момента количества движения и знак спина (рис. 8). Квантовый расчет приводит к двум возможным значениям спиновых квантовых чисел, присущих электрону на орбите: s=+1/2 и s= -1/2, других значений быть не может. Поэтому в атоме на каждой орбите могут вращаться либо два, либо только один электрон. Больше быть не может. Не смешивайте, пожалуйста, буквенное обозначение второго квантового числа l=0 с четвертым квантовым числом. И то и другое обозначают одной и той же буквой — s. Наверное, просто потому, что физикам давно уже не хватает букв для их формул. Эта теория, во многом прояснившая сложное строение атома и связавшая в единое целое его оптические и химические свойства, основана на представлениях, впервые предложенных замечательным датским физиком Нильсом Бором. |
ПОИСК
Block title
|