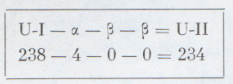|
Меню сайта
|
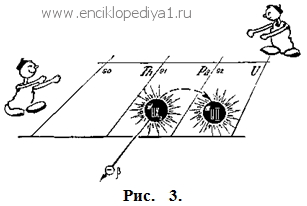
Как радиоактивные элементы нашли свои места в таблице МенделееваКак радиоактивные элементы нашли свои места в таблице МенделееваРазвитие науки поставило периодический закон перед новым, еще более суровым испытанием, чем те, из которых он уже с честью вышел. Это было в конце прошлого — начале нашего века. Во Франции два скромных ученых — супруги Пьер и Мария Кюри — заинтересовались странным явлением, которое открыл другой ученый — Беккерель. Они решили выяснить, почему минералы и руды, содержащие уран, испускают загадочные невидимые лучи, способные проникать через непрозрачные тела и действовать на фотографическую пластинку. Очень скоро они обнаружили, что в природе существуют такие минералы, в которых урана мало, а на пластинку эти минералы действуют гораздо сильнее, чем чистый уран. Супруги Кюри предприняли кропотливые, занявшие долгие годы их жизни поиски новых неведомых элементов — носителей радиоактивного излучения (см. ст. «Рождение, жизнь и смерть химических элементов»). Первым был открыт полоний, вслед за ним — радий. Это были новые элементы, их наука еще не знала. Радиоактивность этих элементов была в тысячи раз сильнее, чем у урана. Чудесные свойства резко отличали их от всех известных ранее элементов. Довольно быстро, как только были изучены химические свойства новых элементов, они нашли свои места в периодической системе. Оказалось, что оба элемента — и полоний, и радий — также когда-то были предсказаны Менделеевым. Радий — это был экабарий, он занял 88-ю клетку в периодической системе, полоний — 84-ю. Его Менделеев называл экателлуром. Значит, место для них было, и казалось, что все благополучно. Но когда были изучены подробно свойства новых радиоактивных элементов, обнаружились совершенно неожиданные для науки явления. Самым важным было то, что с открытием радиоактивных элементов рухнули привычные и, казалось, незыблемые представления о вечности и неизменности каждого элемента. Новые элементы были непостоянными, они рождались и исчезали, превращаясь в другие элементы. Одни из них исчезали в течение миллионных долей секунды, другие жили тысячи лет. Их свойство испускать невидимые лучи свидетельствовало о распаде атомов. Было найдено, что радий — далекий потомок урана. Сам радий превращается в радиоактивный газ радон. И при каждом превращении радиоактивный атом обязательно испускает либо заряженные ядра атомов гелия (α-частицы), либо электроны (β--частицы). Вскоре физики нашли более тридцати радиоактивных элементов. Сколько потомков действительно оказалось у урана, вы можете сами подсчитать на вкладке к статье «Рождение, жизнь и смерть химических элементов» между страницами 288—289. Не меньше потомков было найдено и у элемента тория, который также оказался радиоактивным. И почти столько же — в ряде актиния. Перед наукой снова встал трудный и принципиально важный вопрос: где и как найти места в периодической системе для всех этих новых многочисленных элементов? Их было гораздо больше, чем оставалось свободных клеток в таблице. Эту задачу пришлось науке решать уже без участия Менделеева. Он не дожил до последнего, самого трудного испытания его великой идеи. Химики занялись определением химических свойств новых радиоактивных элементов. Это была трудная задача. Ведь среди этих элементов были такие, которые «жили» ничтожные доли секунды. Разгадка была найдена, когда радиоактивные элементы были настолько изучены, что стало возможным сопоставить природу лучей, испускаемых элементом, с его химической природой и с природой того нового элемента, который из него образуется при радиоактивном превращении. Но разгадать все это удалось опять-таки с помощью периодической системы Менделеева. Изучая свойства урана-Х1 — ближайшего потомка урана, его «сына», химики скоро убедились, что химическими свойствами он неотличим от давно известного тория. Но все же это не был знакомый химикам торий. Торий — обычный элемент, его радиоактивность так слаба, что ее трудно обнаружить. А уран-Х1 сильно радиоактивен, быстро распадается, через 24 дня от него остается только половина того количества, которое было раньше. В общем это новый элемент. Но все же химически это торий. Если уран-X1 смешать с торием, никакими химическими реакциями их разделить невозможно. Уран превращается в уран-Х1, испуская α-лучи (рис. 1). На каждый распавшийся атом урана из его ядра вылетает α-частица и уносит два положительных заряда. Уран занимает 92-е место в таблице, в седьмом периоде. А где должен быть его первый потомок, ypaн-X1? Менделеев поместил торий в 90-ю клетку своей системы. А уран-X1 неотличим от тория. После долгих и трудных поисков и колебаний пришлось признать, что место для урана-X1— в клетке, где находится торий; α-частица уносит из ядра атома два положительных заряда, и при этом образуется новый атом, занимающий в периодической таблице место с номером, на две единицы меньшим. Проследим теперь, что дальше происходит с ураном-Х1 при его распаде (рис. 2).
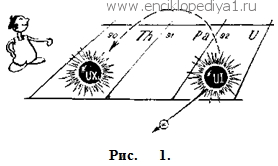
Но потеря одного отрицательного заряда ядром атома равноценна приобретению одною положительного заряда. В результате получилось, что при увеличении положительного заряда ядра элемента на единицу образуется новый элемент, занимающий в периодической системе клетку, номер которой на единицу больше. В свою очередь уран-Х2 снова теряет β--частицу (рис. 3) и превращается в уран-II, который совершенно неотличим от своего «прадеда» — обычного урана — и должен быть помещен в одной клетке с ним, т. е. занять 92-е место в таблице. И всегда увеличение в ядре положительного заряда на единицу (потеря одного отрицательного электрона) приводит к такому изменению химических свойств, которое соответствует увеличению порядкового номера элемента на единицу. Этот закон, управляющий путешествием атомного ядра по менделеевской таблице при радиоактивном распаде, получил в науке название «правило сдвига».
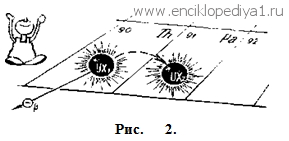
Изучая радиоактивные элементы, химики столкнулись с новым, невозможным и немыслимым с точки зрения старой химии, фактом. Посмотрите сами, что получилось. Атомный вес урана-238. Каждый атом его на пути радиоактивного превращения до урана-II теряет последовательно одну α-частицу (т. е. ядро атома гелия, атомный вес которого 4) и две β--частицы (это легкие, с ничтожной массой электроны). В результате заряд ядра атома радиоактивного урана-II оказывается таким же, как у обычного урана. И своими химическими свойствами он от обычного урана неотличим. Но атомный вес становится, конечно, совершенно другим. Каждая вылетающая α-частица уменьшает атомный вес на четыре единицы, а при β-превращениях он остается таким же. Изменение атомного веса урана:
В одной и той же клетке, где, как считал Менделеев, должен быть только один элемент со своим, присущим только ему атомным весом, теперь оказались два разных вещества, с разными физическими признаками и, самое главное, хотя и с разными атомными весами, но с одинаковыми химическими свойствами. Оказалось, что один и тот же элемент может обладать различным атомным весом. Но этого мало. Был получен еще более удивительный результат: при β-распаде атомный вес не меняется, а химическая природа элемента меняется очень резко. Уран-X1 по химическим свойствам — это торий, а уран-Х2 химически неотличим от элемента протактиния (Ра); следовательно, у разных элементов может быть одинаковый атомный вес. Что же в конце концов получилось? Как основной признак элемента Менделеев принял атомный вес. Но в ряде радиоактивного распада урана конечный продукт — радий-G, его атомный вес 206. Этот элемент уже неактивен, а химически неотличим от свинца. При распаде тория, в конце концов, образуется тоже неактивный торий-D, его атомный вес 208. По химическим свойствам это тоже свинец. Ряд распада актиния обрывается на неактивном продукте — актинии-D, его атомный вес 207, а химически он опять-таки свинец. Но мало этого, в этих рядах есть еще радиоактивные промежуточные продукты распада: радий-В с атомным весом 214, радий-D с атомным весом 210, торий-В, атомный вес которого 212, и актиний-В с атомным весом 211. И все эти радиоактивные элементы, все до одного, абсолютно сходны со свинцом, и все они обладают разными атомными весами. Но ведь в каждой клетке может быть только один элемент с его собственным атомным весом! В клетке 82 может быть свинец с атомным весом 207,18. Изучая радиоактивные элементы, ученые нашли еще семь веществ с атомными весами 214, 212, 211, 210, 208, 207, 206 и химическими свойствами свинца. Наука оказалась в очень большом затруднении. Как же их разместить в периодической таблице? Их нельзя считать разными элементами, все они — свинец, но считать одним элементом, одной разновидностью атомов тоже нельзя — у них разные атомные веса. В конце концов, стало ясно, что все они должны занимать одно место в таблице Менделеева. Именно поэтому их так и называют — «изотопы» (от греческих слов: «равный» и «место»). Кроме того, оставалось необъяснимой загадочная непоследовательность в ходе изменения величины атомного веса у пар элементов аргон— калий, кобальт — никель, теллур — йод. Сам Менделеев был вынужден расположить их в таблице, нарушив порядок увеличения их атомных весов: аргон был «тяжелее» калия, кобальт — никеля, теллур — йода. Это испытание для периодического закона было очень тяжелым. Оно поставило под сомнение основу периодической системы. Стало совершенно ясно, что атомный вес не может служить величиной, которая определяет химические свойства элемента. И наука снова встала перед большой задачей. |
ПОИСК
Block title
|

 Он испытывает
Он испытывает