|
Меню сайта
|
Уравнение состоянияУравнение состоянияИ химику, и теплотехнику, и физику, и конструктору новых космических кораблей мало знать общие закономерности поведения системы вообще. Им нужно рассчитывать совершенно конкретные задачи: один хочет знать, с помощью какой химической реакции он сможет получить новое соединение дешевле и проще; другому необходимо еще более повысить коэффициент полезного действия у двигателя; физик, например, мечтает достичь настолько высоких температур, чтобы можно было осуществить начало термоядерной реакции; космонавтам необходимы еще более тяжелые космические корабли, и им нужно новое топливо, еще более мощное и с большим тяговым усилием. Это примеры очень важных, имеющих огромное значение процессов, в них принимают участие определенные реальные вещества. И свойства этих веществ должны входить в термодинамические расчеты. Для этого нужно знать уравнение состояния вещества. Его нельзя получить при помощи термодинамики. Оно должно быть найдено другим, независимым путем — либо точными измерениями, либо теоретически. Уравнение состояния необходимо термодинамике знать заранее, без него она ничего не может рассчитать. Оно позволяет рассчитать для определенного вещества любую из четырех важнейших величин — количество вещества (т), его объем (v), давление (р) или температуру (Т), если известны три остальные величины:
Удобнее рассматривать всегда один моль газа, тогда уравнение состояния будет проще:
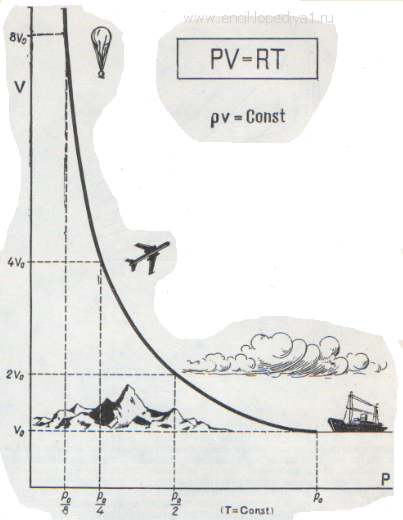
Каждый школьник знает уравнение состояния идеальных газов, его вывел впервые петербургский профессор француз Клапейрон: Это уравнение хорошо описывает поведение одного грамм-моля любого газа при малых давлениях и высоких температурах. Оно очень простое, что сильно облегчает расчеты, и достаточно точное, поэтому его очень часто применяют. Этому замечательному уравнению подчиняются и воздух, которым мы дышим, и раскаленные газы в топках, и плазма внутри звезды, и даже электроны в металле. Выведено оно при допущении, что молекулы газа представляют собой материальные точки: обладают массой, но не имеют объема и никак не взаимодействуют между собою. Поэтому оно и названо уравнением состояния идеальных газов.
Такое допущение определяет область, в которой применяется это уравнение: при низком давлении газ занимает настолько большой объем, что объемом самих молекул можно смело пренебречь, а при высокой температуре молекулы обладают такой большой энергией и такой большой скоростью, что взаимное притяжение не влияет на их движение. Конечно, в действительности нельзя пренебрегать ни собственными размерами молекул, ни их взаимным притяжением.
Поправка к давлению должна быть тем больше, чем ближе друг к другу находятся молекулы в газе, чем более он сжат, чем меньший объем занимает. Эта поправка обратно пропорциональна квадрату объема: чем он меньше, тем ближе друг к другу молекулы и тем больше притяжение, а кроме того, самих молекул в единице объема больше.
Эти поправки ввел в уравнение идеального газа голландский ученый Ван-дер-Ваальс. Он предложил уравнение
которое называется его именем или уравнением реальных газов. R здесь постоянная, которая зависит от количества газа.Это
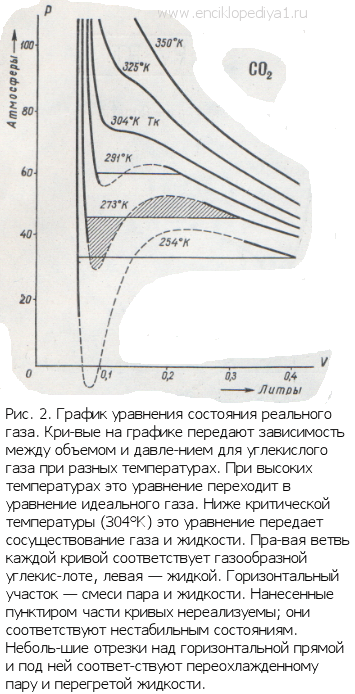
уравнение гораздо более точно, чем уравнение Клапейрона, и применимо в значительно более широких пределах при изменении температуры и давления. Поправки «а» и «6» определяются из опытных данных. Изучив отклонения от идеального газа в изменении объема газа при сжатии, можно даже довольно точно оценить размеры его молекул. 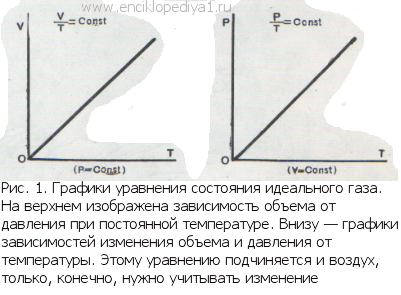
Таким образом, в совокупности свойств, характеризующих состояние системы, нельзя произвольно менять значения всех свойств. Эти значения связаны между собой уравнением. Уравнение состояния обязательно нужно знать, только при этом условии возможно успешно использовать замечательный математический аппарат термодинамики.
|
ПОИСК
Block title
|

 Истинный свободный объем, в котором могут двигаться молекулы, будет меньше объема самого газа, так как часть этого объема занимают сами молекулы (v-b), а давление, под которым находится газ, несколько больше внешнего давления, потому что из-за межмолекулярного притяжения газ испытывает как бы дополнительное сжатие:
Истинный свободный объем, в котором могут двигаться молекулы, будет меньше объема самого газа, так как часть этого объема занимают сами молекулы (v-b), а давление, под которым находится газ, несколько больше внешнего давления, потому что из-за межмолекулярного притяжения газ испытывает как бы дополнительное сжатие: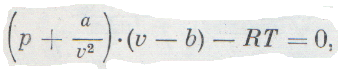
 Знать уравнение состояния очень важно для термодинамики, без него она бессильна при всем своем могуществе. Кроме двух приведенных уравнений состояния, были предложены десятки, а может быть, даже и сотни различных форм уравнений состояния, описывающих поведение различных веществ с возможно большей степенью точности. Многие из них по необходимости весьма сложны, и рассчитывать по ним очень трудно и утомительно. В таких случаях приходится составлять с помощью этих уравнений числовые таблицы, чтобы облегчить практические расчеты.
Знать уравнение состояния очень важно для термодинамики, без него она бессильна при всем своем могуществе. Кроме двух приведенных уравнений состояния, были предложены десятки, а может быть, даже и сотни различных форм уравнений состояния, описывающих поведение различных веществ с возможно большей степенью точности. Многие из них по необходимости весьма сложны, и рассчитывать по ним очень трудно и утомительно. В таких случаях приходится составлять с помощью этих уравнений числовые таблицы, чтобы облегчить практические расчеты. 