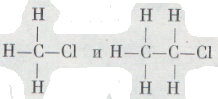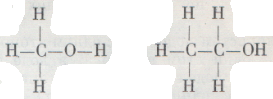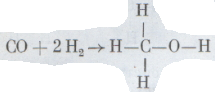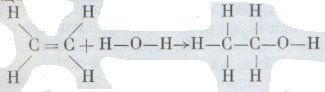|
Меню сайта
|
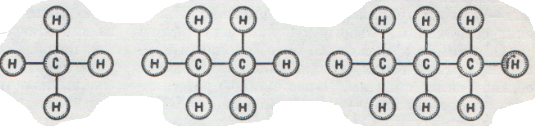
Как химик строит нужную молекулуКак химик строит нужную молекулуПрежде чем построить молекулу, химик должен знать ее состав и структуру (строение), т. е. представлять себе, как взаимно расположены составляющие ее атомы элементов. Строение молекул неорганических веществ выяснить не так трудно. Для этого нужно знать их состав и валентность элементов, из которых они образованы. Валентностью называют число атомов, с которым может соединиться атом того или другого элемента. Рассмотрим это на примерах. Возьмем соединения, состав которых хорошо известен: хлористый водород НСl, вода Н2O, аммиак NH3, болотный, или рудничный, газ — метан СН4. Общее для их состава — водород, но он входит в них в разных количествах. В хлористом водороде с одним атомом хлора соединен один атом водорода, в воде с одним атомом кислорода соединены два атома водорода, в аммиаке с одним атомом азота соединены три атома водорода, в метане с одним атомом углерода соединены четыре атома водорода. Атомы хлора, кислорода, азота и углерода не могут присоединить к себе больше указанного числа атомов водорода. Поэтому говорят, что они обладают определенной валентностью: атом хлора одновалентен, атом кислорода двухвалентен, атом азота трехвалентен, атом углерода четырехвалентен. Само собой разумеется, что атом водорода одновалентен. Из этого следует, что атом кислорода может присоединить к себе два атома хлора, образуя соединение Сl2O, атом углерода — четыре атома хлора, образуя вещество ССl4, или два атома кислорода, образуя соединение СO2. Существуют элементы, атомы которых обладают более высокими валентностями. Вот пример соединений таких атомов: пятихлористый фосфор РСl5, трехокись серы SO3, четырехокись осмия OsO4. Если взять такие количества водорода и хлора, которые будут эквивалентны их относительным атомным весам, то, имея в виду, что оба эти элемента одновалентны, можно попытаться соединить эти количества друг с другом. Действительно, при сильном освещении хлор и водород соединяются именно в таких отношениях без остатка, образуются молекулы хлористого водорода НСl. Подобным же образом реагируют водород с кислородом, если их количества соответствуют отношению двух атомов водорода к одному атому кислорода. Если на такую смесь воздействовать электрической искрой или губчатой платиной, образуется вода. Зная состав даже такого сравнительно сложного соединения, как серная кислота, и валентности составляющих ее элементов, можно предположить, что она образуется соединением одной молекулы воды и одной молекулы трехокиси серы. Водород одновалентен, кислород двухвалентен, а сера шестивалентна. Гораздо сложнее построить или синтезировать органические молекулы. В их состав всегда входят углерод и водород, часто — кислород и азот, иногда — сера или фосфор, хлор, бром или йод, а также металлы. Валентность углерода, водорода, кислорода и азота выражается небольшими числами. Казалось бы, что это не должно усложнять построение органических молекул. Однако у органических соединений есть одна особенность, которая и делает эту задачу очень трудной. Четырехвалентные атомы углерода могут соединяться друг с другом, образуя прямые или разветвленные цепочки либо кольчатые образования. При этом число атомов углерода, принимающих участие в формировании таких молекул, практически неограниченно, следовательно, число органических соединений, или соединений углерода, чрезвычайно велико и во много раз превышает число известных соединений всех других элементов, вместе взятых (см. ст. «Органические вещества вокруг нас»). Знать структуру и строение молекулы — обязательное условие ее синтеза. Простейшее органическое соединение — метан СН4 состоит из углерода и водорода. Его ближайшие соседи — этан С2Н6 и пропан С3Н8. Помня о валентности атомов углерода и водорода и о способности атомов углерода образовывать цепочки, можно прийти к единственно возможным формулам строения этих соединений:
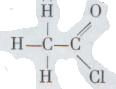
Легко можно составить и формулы строения более сложных углеводородов, в молекулах которых содержится 4, 5, 6 и более атомов углерода и соответствующее число атомов водорода. Как же построены органические молекулы, в состав которых, кроме углерода и водорода, входит атом хлора, например хлористый метил СН3Сl и хлористый этил С2Н5Сl? Для этих соединений, очевидно, можно написать только такие формулы:
Каждая формула показывает, что эти соединения получились при замене одного атома водорода в молекулах метана и этана на атом хлора, причем в данном случае безразлично, какой из атомов водорода замещен атомом хлора.
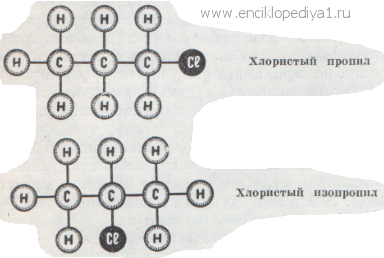
Однако в молекуле, содержащей три атома углерода, т. е. в хлористом пропиле С3Н7Сl, это уже небезразлично. Для этого соединения существуют две формулы в зависимости от того, у какого из углеродных атомов водород замещен на хлор.
Они отличаются друг от друга не только строением, но и физическими и химическими свойствами. Вещества, подобные хлористому пропилу и изопропилу, т. е. состоящие из одинакового числа атомов одних и тех же элементов, называются изомерами, а явление изомерии — одна из причин большого числа органических соединений, известных в настоящее время. Обратимся к несколько более сложным примерам органических соединений, например к органическим спиртам. Простейшие представители этого класса — метиловый спирт СН4O и этиловый спирт С2Н6О. Их состав таков, как будто они получились присоединением одного атома кислорода к углеводородам метану СН4 и этану С2Н6. Однако такое предположение противоречило бы четырехвалентности углерода. О том, как построены эти молекулы, можно судить по некоторым их превращениям. Оказывается, что в каждом из этих спиртов не все атомы водорода ведут себя одинаково: в их молекулах имеется по одному атому водорода, способному выделяться при действии металлического натрия:
Кроме того, при определенных условиях в молекулах этих спиртов хлором заменяется не атом водорода, как в углеводородах СН4 и С2Н6, а группа атомов ОН. При этом образуются знакомые уже нам хлористый метил СН8Сl и хлористый этил С2Н5Сl. Эти превращения позволяют построить формулы строения метилового и этилового спирта:
В этих формулах валентности Н, О и С, о которых мы говорили выше, соблюдены, и в то же время один атом водорода, в отличие от всех остальных, соединен не непосредственно с атомом углерода, а через атом кислорода. Очевидно, этим и объясняется его способность легко заменяться металлом или вместе с кислородом при определенных условиях уступать место хлору. Попробуем теперь, зная строение молекул этих спиртов, построить, или синтезировать, их. Долгое время метиловый спирт получали разлагая древесину нагреванием, а этиловый (винный) спирт и сейчас еще получают при спиртовом брожении крахмала, содержащегося в картофеле или злаках. Оба пути очень сложны. Как химик приступает к построению молекул нужной структуры? Очевидно, так же, как и любой строитель, т. е. прежде всего он составляет план строительства, иначе говоря, составляет архитектурную схему здания и намечает, из каких строительных элементов он будет создавать целое. Но современный строитель применяет уже не отдельные кирпичи, а целые готовые блоки, из которых легче сложить здание. Так поступает и химик. Для построения желаемой молекулы он берет готовые полупродукты известного строения и комбинирует их. Для синтеза метилового спирта, очевидно, было бы целесообразно взять такие вещества, в которых уже есть готовая группа СН3 и группа ОН. Такие вещества известны: это, например, хлористый метил СН3Сl и едкий натр NaOH. Реакция между ними дает метиловый спирт:
По такой же схеме можно получить и этиловый спирт. Но это не единственные пути для синтеза метилового и этилового спирта. Промышленные способы их синтеза совсем иные. В них учтены требования технологии и экономики производства. Метиловый спирт получается из доступной окиси углерода и водорода. Эту смесь, или «водяной газ», можно образовать действием нагретого до высокой температуры водяного пара на уголь: С+Н2O→СО+Н2.
Если прибавить к ней один объем водорода и пропустить новую смесь при высокой температуре и под высоким давлением через соответствующий катализатор, то получится синтетический метиловый спирт, или метанол:
Три атома водорода присоединились к атому углерода, а один атом водорода — к кислороду.
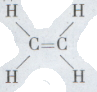
Промышленный синтез этилового спирта осуществляется при высокой температуре и в присутствии катализатора. Водяным паром действуют на газообразный этилен С2Н4, выделяемый из газов крекинга нефти. В молекуле этилена два атома углерода соединены так называемой двойной связью:
Реакция происходит по следующему уравнению:
Один водородный атом воды Присоединился к первому углероду этилена, а гидроксильная группа воды ОН — ко второму. Как же синтезируются более сложные молекулы? Важный класс органических соединений — кислоты. Подобно спиртам, они состоят из углерода, водорода и кислорода, но в молекуле кислоты содержится на два атома водорода меньше и на один атом кислорода больше, чем в молекуле спирта с тем же числом атомов углерода. Сравним состав молекул винного спирта С2Н6O и уксусной кислоты С2Н4O2. Возникает предположение, что уксусную кислоту можно получить из винного спирта, заменяя в нем два атома одновалентного водорода на один атом двухвалентного кислорода путем окисления либо с помощью бактерий уксуснокислого брожения, либо при действии окислителей:
Подобным же образом можно получать и другие органические кислоты из соответствующих спиртов с тем же числом атомов углерода. Для всех этих кислот будет характерна так называемая карбоксильная группа,
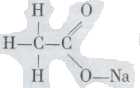
В ней один атом водорода связан, как и в спиртах, с кислородом; поэтому он легко замещается на металлы, образуя соли. У натриевой соли уксусной кислоты, или уксуснокислого натрия, такое строение:
Группа атомов — О — Н в уксусной кислоте и в других кислотах, точно так же как и в спиртах, может быть заменена в соответствующих условиях хлором. Тогда получится соединение:
Оно называется хлорангидридом кислоты (в данном случае уксусной).
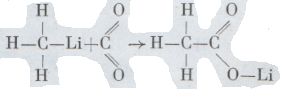
Сравнивая состав уксусной кислоты С2Н4O2 и метана СН4, мы видим, что уксусная кислота отличается от метана одним атомом углерода и двумя атомами кислорода, а это молекула углекислого газа. Нельзя ли соединить непосредственно метан с углекислым газом, чтобы получить уксусную кислоту? К сожалению, этого сделать не удается. Но можно сделать так:
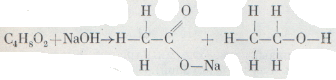
т.е. в метане заместить атом водорода атомом одновалентного металла, например лития. Такое металлоорганическое соединение легко реагирует с газом и дает уксуснокислый литий. Как видим, и в классе органических кислот возможен, как говорят, «направленный синтез», т. е. построение молекул определенной структуры по заранее составленному плану. Синтез кислот — лишь отдельные, наиболее простые примеры такого построения. Кислоты любой сложности и любой структуры могут быть синтезированы с помощью рационально подобранных последовательных реакций. Сложные эфиры, имеющие близкое отношение к спиртам и кислотам, широко распространены в природе — в растительном и животном мире. Летучие сложные эфиры обладают приятными запахами и встречаются в растительных эфирных маслах. Все жиры — растительные и животные — принадлежат к классу сложных эфиров. Сюда же относятся различные виды пчелиного воска, содержащие 55—65 атомов углерода в молекулах. Сложные эфиры при нагревании с едким натром превращаются в натриевую соль кислоты и спирт. При реакции уксусноэтилового эфира С4Н8O2 образуются уже знакомые нам уксуснокислый натрий и этиловый (винный) спирт:
Если мысленно отнять от полученных соединений элементы едкого натра, а оставшиеся части молекул соединить друг с другом, то, очевидно, получится молекула исходного уксусноэтилового эфира:
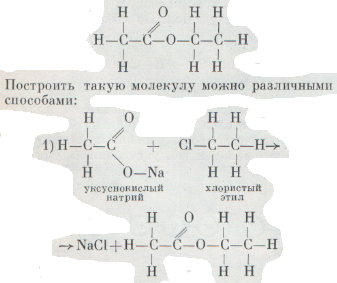 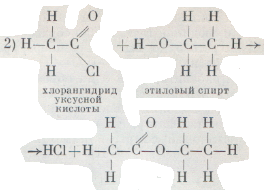 Оба способа действительно приводят к цели, но на практике уксусноэтиловый эфир получают из смеси уксусной кислоты и этилового спирта, нагревая ее с концентрированной серной кислотой: 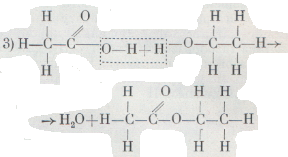
Перечисленными реакциями, конечно, не ограничиваются все возможные пути построения сложных эфиров. Такие пути меняются в зависимости от состава и строения кислоты и спирта, сложности их молекул и т. д. Вообще задача построения нужных молекул не так проста, как может показаться при рассмотрении всех приведенных выше примеров. Иногда десятилетиями ищут удобный и доступный путь для синтеза того или иного вещества. Требуется большое количество промежуточных реакций, чтобы окончательное решение было удачным. Тем не менее в настоящее время химики научились синтезировать очень многие из встречающихся в природе соединений, иногда с очень сложным составом и строением. В наше время сложные природные соединения успешно синтезируют в лабораториях и даже на заводах.
В лабораториях и в промышленности синтезируются, кроме того, многочисленные соединения, не встречающиеся в живой природе. Химики получают в полном смысле слова искусственные материалы.
Строение таких материалов обычно очень сложно, а их свойства, в том числе и механические, часто превосходят свойства самых ценных природных материалов. |
ПОИСК
Block title
|