|
Меню сайта
|
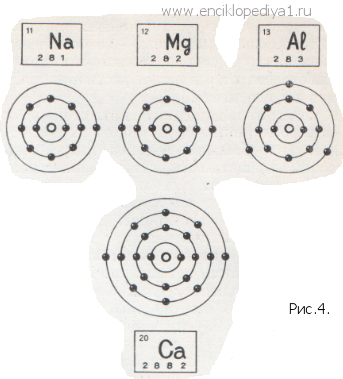
От чего зависит активность металлаОт чего зависит активность металлаАктивный металл легко отдает свои электроны, вступая в химическую реакцию. Сравнить активность нескольких металлов часто помогает всемогущая периодическая система. Вот четыре металла-соседа. Нам известна их электронная структура (рис. 4). Вступить в реакцию для перечисленных металлов означает отдать наружные электроны. Натрий отдаст легче один электрон, чем магний — два или алюминий — три. Поэтому от натрия к алюминию активность металлов уменьшается. Два наружных электрона у кальция дальше от ядра, чем такие же два электрона у магния. Поэтому кальций легче потеряет их, а это и значит, что активность кальция выше, чем магния. Когда речь идет о металлах, стоящих в главных подгруппах периодической системы, можно довольно точно теоретически предсказать, какова будет их относительная активность: чем ниже и левее место металла в системе, тем он активнее. Не нужно, однако, забывать, что активность связана и с тем «партнером», с которым взаимодействует металл. Относительную активность всех остальных металлов теоретически предвидеть гораздо труднее. Здесь на помощь приходит опыт, эксперимент. Простейший опыт может проделать каждый: опустите железный гвоздь в пробирку с раствором медного купороса, очень быстро железо покроется золотистым слоем металлической меди. Что произошло? Ионы меди, чтобы превратиться в металлическую медь, должны вернуть себе два электрона:
Эти электроны и дают меди металлическое железо:
Но если железо расстается со своими электронами, а медь включает их в свою электронную оболочку, то это и значит, что железо активнее.
Более сложные и точные эксперименты помогли выстроить металлы в одну шеренгу по их активности: К Na Mg Al Mn Zn Fe Ni Sn Pb H Cu Hg Ag Почему в этот ряд попал водород? Он имеет на это право потому, что водород по своему химическому характеру во многих реакциях ведет себя как металл (см. ст. «Неметаллы»). Кроме того, один из важнейших признаков, характеризующих металлы,— это отношение к разбавленным кислотам, в которых металлы, стоящие слева от водорода, растворяются, становясь на его место. А может ли водород вытеснять стоящие справа от него металлы из растворов их солей? Да, может. Газообразный водород под давлением способен замещать малоактивные металлы. Чем левее стоит металл в таком ряду активности, тем легче он вступает в химические реакции, отдавая электроны. Вот мы бросили в чашку с водой кусочек металлического натрия. Блестящий шарик бегает по поверхности воды, шипя и потрескивая. То и дело вспыхивает желтый огонек, сердито разбрызгивая во все стороны образовавшийся раствор щелочи. А если кусочек металла взять побольше, то дело может кончиться взрывом! Магний в ряду активностей стоит правее натрия, он реагирует с водой лишь при нагревании. Если же наблюдать взаимодействие железа с водой, то потребуются, пожалуй, недели, а то и месяцы, пока появятся видимые изменения: ржавчина на поверхности железа и совсем небольшое количество водорода, которое можно собрать над водой. Поэтому химик назовет железо сравнительно неактивным металлом. А инженер-технолог с ним не согласится, да еще, пожалуй, и поругает железо за его излишнюю готовность вступать в реакции. Прав каждый по-своему. И наверно, стоит посочувствовать технологам: ведь они-то хорошо знают, что более 10% всего добываемого ежегодно железа приносится в жертву воде, кислотам и другим веществам-агрессорам. А поскольку железо, его сплавы с другими металлами и сами эти металлы — важнейшие конструкционные материалы, без которых невозможна современная техника, то ясно, что проблема химической устойчивости выдвигается на самое первое место. |
ПОИСК
Block title
|