|
Меню сайта
|
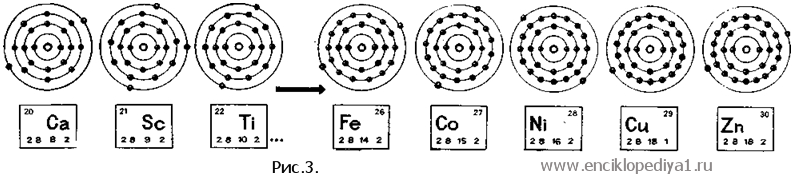
МЕТАЛЛЫ. Что такое металлыМЕТАЛЛЫ. Что такое металлыВ периодической системе металлы преобладают (рис. 1). По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее ее в 22,5 раза (рис. 2). Цезий или галлий можно расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет... Различна и химическая активность металлов — от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия. Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительно заряженные ионы. Элемент легко отдает электроны, если их в наружном слое мало (поэтому элементы первых трех групп, не считая бора,— металлы) ила если радиус атома так велик, что ядро не в состоянии прочно удерживать наружные электроны (поэтому висмут, атом которого имеет в наружном слое пять электронов, все-таки относят к металлам). Проследив, как изменяются свойства у элементов III периода, мы увидим, что с увеличением числа электронов в наружном слое атомов элементы постепенно переходят от активного металла натрия к активному неметаллу хлору. IV период тоже начинается активным металлом калием. В конце этого периода перед инертным газом криптоном также стоит активный неметалл бром. Следовательно, и в этом периоде должен происходить такой же переход. Почему же этот переход такой медленный? Дело в том, что у элементов IV периода от скандия до цинка «достраивается» не наружный электронный слой, а предыдущий (рис. 3). И лишь после цинка (начиная с галлия) число электронов в наружном слое увеличивается, так что у германия здесь четыре электрона. Он — «пограничный» элемент, за которым следуют неметаллы. Поскольку у элементов от скандия до никеля в наружном слое не больше двух электронов, то они — металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов. У этих рядов четные номера (4, 6, 8,10), а из большинства расположенных в них металлов состоят побочные подгруппы периодической системы. Металлы, стоящие в середине больших периодов и последовательно «достраивающие» не наружный, а более глубоко лежащие электронные слои, называют переходными металлами. Переходные металлы, как правило, проявляют переменную валентность, и потому их соединения гораздо многочисленнее и разнообразнее, чем соединения металлов главных подгрупп периодической системы. Так, ванадий способен, вступая в химические реакции, отдавать один за другим все пять своих валентных электронов, изменяя свою валентность от +2 до +5. Интересно, что при этом получаются соединения красивой окраски, характерной для каждой из этих валентностей. Максимальная валентность переходных металлов равна номеру группы. Правда, у большинства элементов VIII группы валентность ниже максимальной (см. ст. «Великий закон»). Проявляя максимальную валентность, металлы побочных подгрупп в своих соединениях становятся похожими на соседей из главных подгрупп. Так, семивалентный марганец входит в состав марганцевой кислоты НМnO4, похожей по строению молекулы на хлорную кислоту НСlO4. Если металл проявляет переменную валентность, то окислам высшей валентности отвечают кислоты, низшей — основания. Окислы, в которых валентность металла промежуточна, амфотерны, т. е. способны в зависимости от условий проявлять как кислотные, так и основные свойства. |
ПОИСК
Block title
|