|
Меню сайта
|
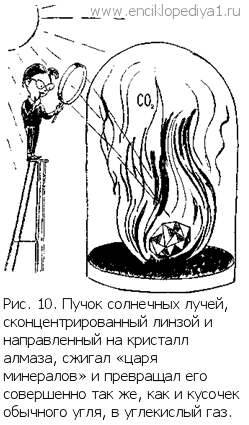
Свободные неметаллы в природеСвободные неметаллы в природеВ число десяти элементов, знакомых людям с глубокой древности, входят два неметалла — углерод и сера. Оба элемента встречаются в природе в свободном состоянии. Молекула серы состоит из восьми атомов, соединяющихся друг с другом в кольцо. При нагревании такие кольца разрываются, а при более высокой температуре образовавшиеся цепочки укорачиваются, так что сера становится смесью молекул, содержащих 8, 6 и 2 атома. При очень высокой температуре пары серы состоят из молекул S2, т. е. построены так же, как молекулы кислорода, азота, хлора в обычных условиях. Самое устойчивое состояние серы — кольцеобразная молекула S8. При быстром охлаждении расплавленной серы разорванные кольца не успевают замкнуться и сера становится пластичной, а затем, превращаясь в самую устойчивую форму, возвращает себе привычный внешний вид и свойства. Так проявляется один из самых универсальных законов: все процессы в природе идут так, чтобы достигалось самое устойчивое состояние, энергия которого самая маленькая (камень падает с горы, потому что у ее подножия он будет обладать самой маленькой потенциальной энергией; сжатая пружина разжимается, потому что это ведет к снижению ее потенциальной энергии; атом любого элемента стремится к образованию устойчивой наружной оболочки, так как это тоже отвечает минимуму энергии). Углерод встречается в природе в двух различных формах (аллотропических видоизменениях), отличающихся друг от друга строением кристаллической решетки: это — алмаз и графит. Люди не сразу пришли к пониманию того, что благороднейший алмаз и невзрачный уголь — близнецы. А между тем установить это было совсем просто: в один прекрасный день с помощью линзы сконцентрировали солнечные лучи на кристаллике алмаза, помещенного под стеклянный колпак. Алмаз... сгорел, а под колпаком образовался углекислый газ — тот же самый, что образуется при горении угля...
Если алмаз — одно из редчайших произведений природы, то графит и уголь образуют мощные залежи. Правда, уголь почти никогда не состоит из чистого углерода, а всегда содержит различные примеси. Недавно было установлено, что обычная сажа имеет строение, похожее на строение графита. В течение долгого времени она причиняла людям одни неприятности, засоряя дымоходы, загрязняя воздух. Сажу использовали лишь для приготовления красок, туши и т. п. Но в последние десятилетия ее стали специально готовить, причем для этого пришлось строить большие заводы, придумывать способ сжигать топливо так, чтобы сажи получалось как можно больше. Сажа — необходимый компонент при изготовлении резины из каучука. Специальным образом приготовленный аморфный углерод широко используется для поглощения (адсорбции) многих веществ и как основа для нанесения катализаторов.
Графит очень нужен людям не только для карандашей. Порошок графита — хорошая смазка для трущихся частей машин. Из графита делают электроды для различных электрических устройств, потому что графит хорошо проводит электрический ток, и это, пожалуй, единственный пример хорошей электропроводности среди неметаллов. Азот и кислород составляют 99% атмосферы нашей планеты (78%— азот и 21%— кислород). Галогены встречаются в природе в виде различных соединений, и это понятно — ведь они очень активны. Но кислород тоже очень активный неметалл. Как же это совместить с большим количеством свободного кислорода в природе? Нет ли здесь какого-то противоречия? Все дело в огромной роли, которую играют в химии Земли растения. Это они — действующие «фабрики» — производят кислород. Если бы вдруг в один совсем не прекрасный день весь растительный мир перестал существовать, количество кислорода немедленно начало бы уменьшаться, а через 3000 лет в атмосфере совсем не осталось бы кислорода... И все же высокая химическая активность кислорода сказывается на его судьбе. Количество свободного кислорода 1015 т, т. е. 1 миллион миллиардов тонн. В соединениях с другими элементами его содержится в 10 000 раз больше. Без кислорода нет дыхания, а без дыхания нет жизни. Но значение кислорода для жизни не ограничивается только этим. Из двух аллотропных видоизменений кислорода — «обычного» кислорода O2 и озона O3 — устойчивой является именно первая форма.
О кислороде обычно говорят: «газ без цвета, без запаха, без вкуса». Это верно, но лишь для привычных нам условий. Если обычный воздух охладить ниже -150° под давлением в 40 атм, он превращается в бесцветную жидкость. Если такую жидкость поместить в специальные сосуды с двойными стенками из зеркального стекла, между которыми выкачан воздух, то жидкий воздух медленно испаряется, причем легче улетучивается азот. Поэтому в конце концов в сосуде останется чистый жидкий кислород. Оказывается, жидкий кислород совсем не бесцветный, а голубой... Его помещают под давлением в стальные баллоны и используют там, где это необходимо. А необходимость в кислороде большая. Для выплавки чугуна, например, в домну вдувают воздух, необходимый для сгорания топлива. Но необходим-то только кислород, а азот активно мешает процессу, уносит тепло, ухудшает качество металла. Поэтому в доменном процессе очень перспективно применение чистого кислорода. Жидкий кислород используют в качестве окислителя топлива в некоторых системах космических ракет. Азот — «безжизненный» газ, как его назвали когда-то (он не поддерживает горения и дыхания),— интересный неметалл. Молекула N2 очень прочна, поэтому азот с трудом вступает в реакции. Свободный азот — самая устойчивая форма существования этого элемента в природе. Значительная часть азота на Земле находится именно в атмосфере, а те сравнительно небольшие скопления соединений азота, которые есть на Земле, обязаны своим происхождением в основном живым организмам. Мы уже знаем, что растения освобождают кислород и выделяют его в атмосферу. С азотом дело обстоит как раз наоборот: живые организмы связывают азот атмосферы. Подсчитано, что так называемые азотобактерии, живущие в почве, способны за год связать 50 кг азота на каждом гектаре Земли. Бактерии же, обитающие на корнях бобовых растений, перерабатывают втрое больше атмосферного азота в расчете на 1 га! Есть бактерии, «работающие» в обратном направлении,— они возвращают связанный в соли азотной кислоты элемент опять в атмосферу. При электрических разрядах в атмосфере во время грозы азот вступает в соединение с кислородом и в конце концов превращается в азотную кислоту. Потоки азотной кислоты, льющиеся на землю с грозовым дождем! Не слишком ли это преувеличено? Судите сами: в среднем на всех материках происходит более 40 000 гроз в день, и эти грозы приносят ежегодно около 15 кг связанного азота на 1 га земной поверхности. В наше время в судьбу азота активно вмешался человек. Еще 140 лет назад первую партию чилийской селитры — одного из важнейших азотных удобрений — выбросили в море ... за ненадобностью. Сегодня на сотнях заводов превращают атмосферный азот в химические соединения, без которых невозможна ни современная промышленность, ни сельскохозяйственное производство. Один из методов связывания атмосферного азота подражает природе: смесь азота и кислорода пропускают через электрическую дугу и получают окисел N0, который далее легко реагирует с кислородом воздуха, превращаясь в бурый NO2. При растворении в воде он дает азотную кислоту. Этот метод сейчас отступает перед самым распространенным процессом — синтезом аммиака из смеси азота и водорода в присутствии катализатора:
Если вы внимательно читали эту главу, вы обязательно должны задать коварный вопрос: все процессы в природе должны вести к уменьшению энергии, все элементы должны находиться в своей самой устойчивой форме — «камень обязательно должен упасть»?. Как же может случиться, что кислород находится не в устойчивой форме своих соединений, а в свободном состоянии; наоборот, почему же азот, максимально устойчивый в своем элементарном состоянии, все же превращается в различные соединения? Частично мы уже ответили на этот вопрос, подчеркнув роль живых организмов в судьбе этих двух элементов. Да, «камень должен упасть», если он предоставлен самому себе. Но не требует доказательств тот очевидный факт, что любой из нас может взять этот упавший камень и поднять его обратно на гору. Для этого нужно лишь затратить энергию. Теперь ясно, почему растения способны произвести превращения, о которых мы рассказали: ведь они затрачивают энергию, которую получают от Солнца. Подсчитано, что масса живого вещества на Земле составляет один грамм на каждый квадратный сантиметр поверхности. Много ли это? Много! Ведь только благодаря участию живых организмов в атмосфере появился свободный кислород, на суше и в морях образовались огромные залежи известняков, мела, фосфоритов, углей, нефти. Недаром эти минералы называют биолитами. Растения вмешиваются в распределение элементов в земной коре, концентрируя одни из них, способствуя рассеиванию других. В течение года растения фиксируют 8,2 млрд. т азота и 184 млрд. т углерода. Не удивительно поэтому, что общий вес живых организмов в 2,5 раза превышает вес всего никеля, хрома, цинка, свинца и золота земной коры, вместе взятых. |
ПОИСК
Block title
|

 Озон довольно быстро превращается в «обычный» кислород, если не успевает вступать в реакцию с другими веществами. Солнце могло бы стать причиной гибели всего живого, потому что, кроме благодатного тепла и света, оно посылает на Землю разящий поток губительных ультрафиолетовых лучей. И защищает нас от этого врага невидимое кислородное «одеяло»: на большой высоте ультрафиолетовые лучи встречаются с молекулами кислорода, «разбивают» их и превращают в молекулы озона. Образовавшийся озон и задерживает смертоносное излучение Солнца.
Озон довольно быстро превращается в «обычный» кислород, если не успевает вступать в реакцию с другими веществами. Солнце могло бы стать причиной гибели всего живого, потому что, кроме благодатного тепла и света, оно посылает на Землю разящий поток губительных ультрафиолетовых лучей. И защищает нас от этого врага невидимое кислородное «одеяло»: на большой высоте ультрафиолетовые лучи встречаются с молекулами кислорода, «разбивают» их и превращают в молекулы озона. Образовавшийся озон и задерживает смертоносное излучение Солнца. 
