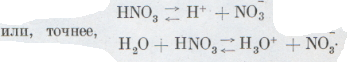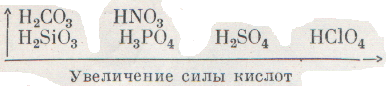|
Меню сайта
|
Кислородные соединения неметалловКислородные соединения неметалловНеметаллы, за исключением галогенов, с большей или меньшей легкостью соединяются с кислородом и образуют окислы. Окислы галогенов получают косвенным путем. Как известно, большинство неметаллов может иметь переменную валентность. Поэтому известен не один, а несколько окислов каждого неметалла: два — для углерода (СO2 и СО), пять — для азота, два — для серы и т. д. В окислах отчетливо проявляются свойства неметаллов и их периодичность. Возьмем, к примеру, высшие окислы неметаллов третьего периода. Вот они: SiO2, P2O5, SO3, Сl2O7. Как и положено окислам неметаллов, их гидраты — это кислоты:
Сила кислоты определяется легкостью, с которой кислота в водном растворе диссоциирует, давая ионы водорода:
Поэтому кислота тем сильнее, чем прочнее связь центрального атома неметалла с кислородом и чем слабее связь с кислородом атома водорода. Ясно, что увеличение заряда, т. е. рост валентности центрального атома неметалла, и уменьшение его радиуса увеличивает силу кислоты. Так, кремневая кислота — слабая, фосфорная — средней силы, серная — сильная, хлорная — очень сильная кислота. В то же время известно, что угольная кислота сильнее кремневой, а азотная сильнее фосфорной:
Если неметалл образует несколько кислот, то наиболее сильной из них будет та, в которой неметалл проявляет максимальную валентность. Например, серная кислота (сильная) и сернистая кислота (слабая). Или ряд кислот хлора:
Окислы низших валентностей часто совсем не взаимодействуют с водой и потому называются безразличными: СО, N2O, NO. Отметим два особенных окисла. Один из них — соединение фтора с кислородом. Получают его, пропуская фтор через слабый раствор щелочи:
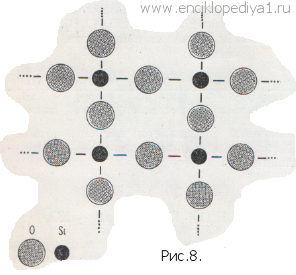
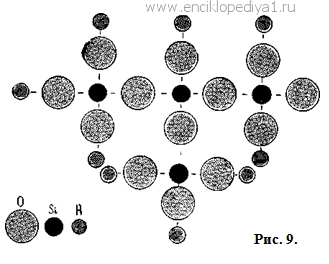
В этом соединении — и только в нем! — кислород проявляет положительную валентность, так как электронные пары, связывающие атомы фтора с кислородом, смещены к более активному фтору. Другая интересная особенность характерна для двуокиси кремния. В отличие от газообразной двуокиси углерода, своего ближайшего аналога, SiO2 — вещество твердое, прочное и тугоплавкое (плавится лишь при 1713°!). Это объясняется особенным строением кристалла двуокиси кремния. Как видно на рисунке 8, каждый атом кремния в кристалле фактически связан не с двумя атомами кислорода, как в молекуле СО2, а с четырьмя, так что образуется очень прочная структура. По этой причине двуокись кремния не растворяется в воде, а кремневая кислота, отвечающая этому окислу и получаемая косвенным путем, также состоит не из отдельных молекул H2SiO3, а частично сохраняет свойственную двуокиси кремния сетчатую структуру (рис. 9). Именно поэтому кремневая кислота, в отличие от других минеральных кислот, нерастворима в воде, не является жидкостью и нелетуча. |
ПОИСК
Block title
|