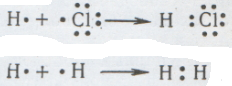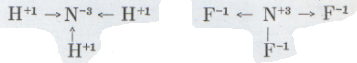|
Меню сайта
|
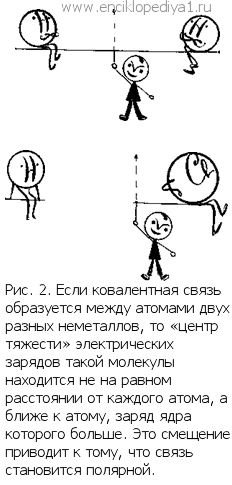
Правило электронных парПравило электронных парОказывается, закономерности, управляющие движением электронов на оболочках атомов, таковы, что наиболее выгодно состояние, при котором все электроны распределены по парам и их общее число четное. Например, хлор или йод, на последней оболочке атома которых движутся семь электронов, проявляют преимущественно только нечетную валентность: -1, +1, +3, +5, +7. Сера (6 электронов на последней оболочке) в своих устойчивых соединениях проявляет четную валентность: -2, +4, +6. Почему так ? А вот почему: отдай сера 3 электрона, она имела бы валентность + 3, но тогда один из оставшихся трех электронов был бы непарным, а это невыгодно. Хлор же, отдав нечетное число электронов, все оставшиеся электроны группирует по парам. Поэтому-то валентность его только нечетная. Ковалентная связь, при которой два атома имеют общую пару электронов, очень характерна для неметаллов. Но если соединились неодинаковые атомы (например, хлор и водород), то общая электронная пара все же больше принадлежит активному неметаллу. Она как бы «сдвинута» ближе к более активному неметаллу. Такую ковалентную связь называют полярной.
Но если такой «сдвиг» произошел, то в молекуле Н+Сl-водород частично положителен, а хлор частично отрицателен: обе эти частицы еще не ионы, но это уже, так сказать, «зародыш» ионов, которые образуются, например, в растворе хлористого водорода под действием молекул воды. А вот молекула водорода ионов в водном растворе дать не может, потому что в этой молекуле таких ионов нет даже в «зародыше». Теперь мы можем смело употреблять выражение: «неметалл А отдал неметаллу Б свои электроны», понимая, что речь идет не о полной отдаче, а о «сдвиге» электронов в сторону более активного неметалла. И в этом смысле более активный неметалл становится отрицательным, а менее активный — положительным:
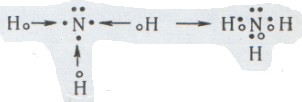
Как правило, соединяющиеся неметаллы создают общую электронную пару «на равных условиях» — каждый отдает в общее пользование по одному электрону. Но бывает и иначе... Вот как образуется молекула аммиака из атомов азота и водорода:
Как видно из этой схемы, три электронные пары, созданные «общими усилиями», связывают атом азота с тремя атомами водорода, а одна электронная пара азота остается «свободной», незанятой. Но стоит аммиаку попасть в раствор какой-нибудь кислоты, содержащий ионы водорода (в них водород лишен своего электрона), как такие ионы «зайцем» занимают свободную электронную пару азота — и уже невозможно отличить «бесплатного» пассажира от трех других атомов водорода. Так образуется комплексный ион аммония NH4+, а связь, образованную парой электронов, ранее принадлежавшей целиком одному атому, называют координационной связью.
Ионы водорода в водных растворах связываются с молекулами воды координационной связью и дают комплексный ион гидроксония Н3О+, так что представление о том, что в растворах кислоты существуют свободные ионы водорода, нуждается в уточнении. |
ПОИСК
Block title
|