|
Меню сайта
|
Почему мыла моютПочему мыла моютМылообразные поверхностно-активные вещества образуют в воде коллоидные растворы: при определенной концентрации несколько десятков молекул или ионов мыла объединяются в агрегаты — мицеллы (рис. 2).
Поверхности, покрытые такими мицеллярными адсорбционными слоями в растворах мыл, всегда хорошо смачиваются водой. Этому помогает сильно пониженное поверхностное натяжение воды на границе с воздухом. Именно поэтому одно и то же вещество может в очень малой концентрации делать твердую поверхность гидрофобной, в большой концентрации давать прямо противоположный результат — обеспечивать смачивание водой любую гидрофобную поверхность (рис. 3).
Нальем в стеклянный сосуд (бутылку) воду и, встряхивая, будем понемногу добавлять туда керосин или бензин. Капельки бензина тотчас же начнут сливаться в крупные капли, и смесь разделится на два жидких слоя. Теперь повторим опыт, добавив к воде 1—5% мыла. При встряхивании образуется молочно-белая устойчивая эмульсия, в которой отдельные капельки, не превышающие сотых долей миллиметра, защищены от слияния адсорбционными оболочками мыла. Водный раствор мыла занимает двадцатую часть сосуда, но его хватает на эмульгирование в двадцать раз большего объема бензина. Весь бензин разобьется на мельчайшие капельки, плотно прижатые друг к другу, но устойчиво разделенные тонкими прослойками мыльного раствора. Такие концентрированные эмульсии очень вязки, они напоминают сметану. Кстати, и сметана, и сливки, и молоко — это эмульсии жира в воде, стабилизованные белковым веществом — альбумином. Попробуем разрезать кончиком стеклянной палочки слой ртути толщиной 2—3 мм, покрывающий дно плоской чашечки или блюдца под водой (рис. 4).
Время жизни таких разрезов возрастает по мере насыщения адсорбционного слоя и характеризует стабилизирующую способность данного поверхностно-активного вещества. Так почему же мыло моет, почему оно легко отмывает с любой поверхности грязь — сажу, масло, нефть? Именно потому, что оно обладает смачивающей и стабилизирующей способностью. Мыло переводит всю грязь в воду в виде тонко дисперсных суспензий и эмульсий. Обычное мыло — натриевые соли жирных кислот — без труда справляется с грязью в мягкой воде, в которой нет солей кальция и магния. В жесткой же воде мыло осаждается в виде нерастворимых кальциевых и магниевых мыл, раствор теряет свою моющую способность. Однако химики создали синтетические мылообразные (моющие) вещества, пригодные для любой воды, даже для морской; особенно хороши не ионные мыла, совершенно устойчивые к действию солей. Моющие средства и смачиватели используются и в быту, и в промышленности, и в сельском хозяйстве. Смачиватели применяют в изготовлении фото кинопленки, когда прозрачную полимерную ленту надо равномерно полить светочувствительным составом высокодисперсной взвесью бромистого серебра на водном растворе желатины. Смачиватель, добавленный в ванну, где окрашивают волокно и ткань, ускоряет процесс и делает окрашивание равномерным. Полное смачивание — необходимое условие для взаимодействия жидкости с твердым телом, для проникновения жидкости в тонкие поры. Поэтому-то все ядохимикаты и гербициды, применяемые в сельском хозяйстве, содержат поверхностно-активные вещества. Лучше всего действуют такие средства в виде тонко дисперсных эмульсий или суспензий. Поверхностно-активные вещества в них служат и смачивателями и стабилизаторами действующего яда. Порошок ДДТ, например, не смачивается водой, и из него нельзя приготовить раствор для опрыскивания. Но тот же порошок с добавкой смачивателя равномерно распределяется в воде, образуя в ней устойчивую суспензию, прочно прилипающую к поверхности листвы и вредителей. Смачиватели несут самую разнообразную службу. Например, чтобы избавить шахтеров от вредной пыли, в шахтах распыляют воду с добавкой смачивателя. Пыль улавливается такой водой, и воздух становится чище. |
ПОИСК
Block title
|
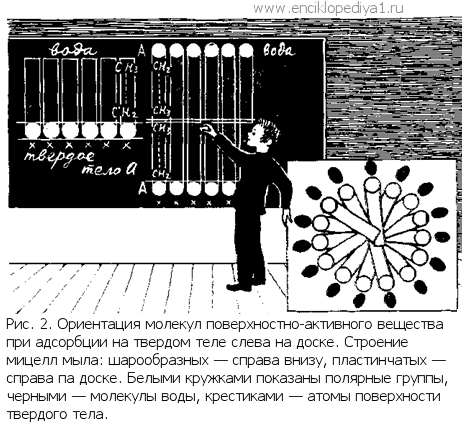 Мицеллы имеют шарообразную форму с гидрофильной оболочкой из полярных групп и гидрофобным ядром из углеводородных цепей. С ростом концентрации мицеллы становятся пластинчатыми — прослойки из углеводородных цепей покрыты с обеих сторон полярными группами. Такие пластинчатые мицеллы становятся зародышами кристалликов мыла. Пластинчатые мицеллы сцепляются углеводородными цепями крайних молекул в пространственные сетки-каркасы, и раствор, как говорят, структурируется —приобретает свойства упругого твердого тела, напоминающего желе и называемого гелем.
Мицеллы имеют шарообразную форму с гидрофильной оболочкой из полярных групп и гидрофобным ядром из углеводородных цепей. С ростом концентрации мицеллы становятся пластинчатыми — прослойки из углеводородных цепей покрыты с обеих сторон полярными группами. Такие пластинчатые мицеллы становятся зародышами кристалликов мыла. Пластинчатые мицеллы сцепляются углеводородными цепями крайних молекул в пространственные сетки-каркасы, и раствор, как говорят, структурируется —приобретает свойства упругого твердого тела, напоминающего желе и называемого гелем.  Но мыла не только смачиватели; они и сильные стабилизаторы, обеспечивающие устойчивость жидких пленок (вспомним знакомые всем мыльные пузыри) — пен, а также всех дисперсных систем — эмульсий и суспензий. В эмульсиях мелкие капельки одной жидкости, не смешиваясь, распределяются в другой жидкости. Под действием поверхностной энергии они при соприкосновении стремятся слиться друг с другом. Подобно этому сцепляются в агрегаты и частицы твердого тела, образующие суспензию в жидкой среде. Стабилизатор же создает на поверхности капелек эмульсии или частиц суспензии гелеобразный (структурированный) адсорбционный слой, который препятствует сближению и взаимодействию частиц.
Но мыла не только смачиватели; они и сильные стабилизаторы, обеспечивающие устойчивость жидких пленок (вспомним знакомые всем мыльные пузыри) — пен, а также всех дисперсных систем — эмульсий и суспензий. В эмульсиях мелкие капельки одной жидкости, не смешиваясь, распределяются в другой жидкости. Под действием поверхностной энергии они при соприкосновении стремятся слиться друг с другом. Подобно этому сцепляются в агрегаты и частицы твердого тела, образующие суспензию в жидкой среде. Стабилизатор же создает на поверхности капелек эмульсии или частиц суспензии гелеобразный (структурированный) адсорбционный слой, который препятствует сближению и взаимодействию частиц.  Такой разрез сделать нельзя: он тотчас же «залечивается» — смыкается под действием поверхностного натяжения на границе ртуть — вода. Однако, если к воде добавить один процент сапонина — экстракта из мыльного корня, разрез стабилизируется структурированными адсорбционными слоями. Они примут форму, соответствующую минимуму свободной энергии, которую можно рассчитать математически. Разрез должен кончаться у краев слоя ртути или замыкаться на себя, образуя кружок — кольцо. В одной точке могут пересекаться только три разреза, образуя равные углы в 120°.
Такой разрез сделать нельзя: он тотчас же «залечивается» — смыкается под действием поверхностного натяжения на границе ртуть — вода. Однако, если к воде добавить один процент сапонина — экстракта из мыльного корня, разрез стабилизируется структурированными адсорбционными слоями. Они примут форму, соответствующую минимуму свободной энергии, которую можно рассчитать математически. Разрез должен кончаться у краев слоя ртути или замыкаться на себя, образуя кружок — кольцо. В одной точке могут пересекаться только три разреза, образуя равные углы в 120°. 