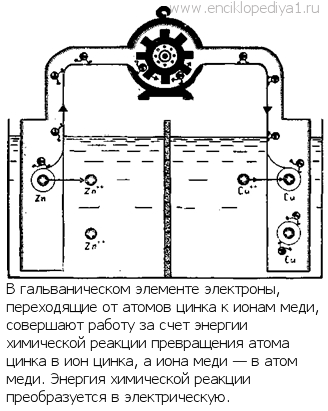
|
Меню сайта
|
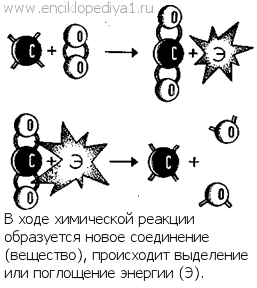
Химическая реакцияХимическая реакцияСимволы ста четырех элементов заполняют клетки периодической системы. Подавляющее большинство из них получено в свободном виде. А между тем в природе химические элементы встречаются главным образом в форме самых разнообразных соединений. Извлечь тот или иной элемент из минерала или горной породы часто нелегко, и сделать это удается с помощью целого комплекса химических процессов. Эти процессы и есть химические реакции. Количество известных химических соединений — от простейших до самых сложных — превышает 2 млн. Все они, а также и те, с которыми еще предстоит встретиться исследователям,— результат химического взаимодействия элементов, продукт химических реакций. Ежесекундно во Вселенной происходит бесчисленное множество химических реакций. ...Вы пробегаете глазами эти строки, улавливаете их смысл, и в вашем мозге совершаются сотни и тысячи различных химических реакций. Если в стакан крепкого чая положить кусочек лимона, цвет напитка бледнеет: произошла химическая реакция. Топится печь, пляшут яркие огоньки пламени, и от смолистых поленьев остается кучка золы. Это превращение осуществилось благодаря химическим реакциям. Реакция горения — первая химическая реакция, с которой познакомился человек. А потому легенду о Прометее, подарившем людям огонь, можно считать легендой о том, как человек впервые столкнулся с химическими взаимодействиями. ...Весь облик нашей Земли, ее леса и горы, ее почвы и воды созданы химическими превращениями. Уголь, который дает нам электричество; нефть — топливо, приводящее в движение автомобили и самолеты; металлы, выплавленные из руд, — все это продукты химических реакций. В своем понимании химической реакции человек прошел длинный путь. Дикарь, который с удивлением наблюдал, как молния превращает могучее дерево в уголь и золу, и современные исследователи, который вплотную подошли к синтезу белка, одного из самых сложных веществ,— вот две крайности в представлениях человека о химических реакциях. Когда простые или сложные вещества вступают во взаимодействие друг с другом, они обычно дают знать об этом. Стоит бросить в раствор серной кислоты кусочек цинка, как моментально от него побегут пузырьки газа. Пройдет некоторое время, и металл исчезнет. Цинк растворился в кислоте, и выделился водород. Как все это происходило, вы видели своими глазами. Если поджечь комок серы, он загорится голубоватым пламенем, появится удушливый запах. Сера соединилась с кислородом и образовала химическое соединение — сернистый ангидрид. Польем белый порошок безводной сернокислой меди CuSO4 водой, он синеет. Соль соединилась с водой, и образовалось соединение — синие кристаллы медного купороса — CuSO4•7H2O. Вещества такого вида называются кристаллогидратами. Всем знаком процесс гашения извести. Негашеную известь СаО обливают водой, получается «гашенка» Са(ОН)2. Цвет вещества не изменился, но легко убедиться, что реакция прошла. При гашении извести выделяется много тепла. Химические реакции проходят с выделением или поглощением энергии, чаще всего тепловой. Вот первое непременное условие всех химических реакций. Иногда тепла выделяется так много, что это легко обнаружить на ощупь. Реакции, идущие с выделением тепла, называют экзотермическими.Гашение извести — это пример экзотермической реакции:
Известно множество экзотермических реакций, где тепла
выделяется несравненно больше, например горение бора в кислороде: Образование озона — хороший пример эндотермической
реакции, идущей с поглощением тепла: 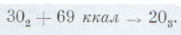 Соединения, которые образуются с выделением энергии, называются экзотермичными. Их гораздо больше, чем соединений эндотермичных, образующихся с поглощением энергии. Таков, например, озон. Все эндотермичные соединения в большей или меньшей степени неустойчивы. Царство химических реакций — это сложнейшая область, и изучают ее самые различные науки. Чтобы понять, как происходит та или иная реакция, химик призывает на помощь и физику, и математику, и биологию. Он часто нуждается в услугах хитроумных вычислительных машин. Разные химические процессы протекают с различной
скоростью. Одни совершаются мгновенно, другие так медленно, что на первый
взгляд кажется, будто реакция не идет совсем. Таких «незаметных» реакций очень
много, и среди них есть очень важные, жизненно необходимые для практики, для
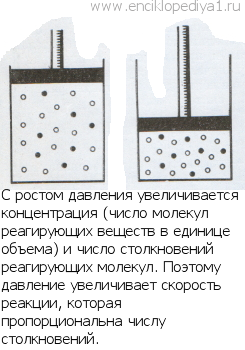
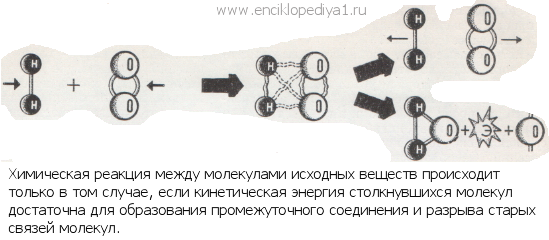
получения нужных человеку веществ. Взрыв — вот пример мгновенной реакции. Здесь счет идет на доли секунды. Твердое взрывчатое вещество превращается в газообразные продукты. Процесс ржавления, или коррозии, железа наносит громадный убыток человечеству. Более 10 % производимого металла теряется бесполезно. Коррозия — пример коварного процесса, она протекает постепенно. Вечером железная пластинка будет такой же, как утром, но пройдет несколько дней, и на ее поверхности появляются рыжеватые разводы ржавчины. Процесс коррозии во многом зависит от окружающих условий. В тропических странах, где высокая влажность и жарко, стальные и железные изделия ржавеют быстрее, чем в средних широтах. Обратите внимание, что повышенная температура ускоряет коррозию. А вот, допустим, в стеклянном сосуде смешаны два газа — водород и кислород, составные части воды. Сосуд при комнатной температуре (15—20°Ц) может стоять сколько угодно, и на поверхности стекла не будет заметно ни единой капельки влаги. Кажется, что водород вовсе и не соединяется с кислородом. Соединение идет, но только чрезвычайно медленно. Чтобы на донышке сосуда образовалась лужица воды, должны пройти тысячелетия. В чем же дело? Оказывается, комнатная температура слишком низка, чтобы водород и кислород вступили в быстрое взаимодействие. Но если нагревать сосуд, стенки его запотевают. Это верный признак протекающей реакции. А при 500°Ц сосуд разлетится на мелкие осколки. При такой температуре образующие воду газы реагируют со взрывом. Но всегда ли это происходит так? Нет, не всегда. Чтобы образовался один объем водяного пара, нужно взять два объема водорода и один объем кислорода. Эту смесь называют также гремучим газом: при нагревании она взрывается. Если же количество водорода в смеси менее 4% или более 94% (по объему), то такая смесь не взрывоопасна. Скорость химической реакции зависит не только от температуры, но и от концентрации реагирующих продуктов. Температура и концентрация — вот те важнейшие понятия, которыми оперирует химическая кинетика — наука о скоростях химических реакций. Ее основной девиз: обеспечить полноту протекания химического процесса, получить наибольший выход нужного продукта. Ради этого химик-кинетик становится и физиком и математиком. И он ставит перед собой задачу — рассчитать химическую реакцию. Итак, прежде чем смешивать исходные вещества, химик задается вопросом: при какой температуре пойдет реакция? При обычной, комнатной, начинаются немногие. Уголь не загорается сам собой, смесь порошков магния и серы так и остается смесью. Стоит лишь подвести к ним пламя — реакции начинаются тут же. Почему же тепло способно заводить механизм химического процесса? Вернемся снова к воде. Водород и кислород в свободном виде существуют в форме молекул Н2 и O2. Чтобы эти молекулы могли прореагировать, они должны столкнуться. И чем чаще будут такие столкновения, тем вероятнее образование молекулы воды. При комнатной температуре и нормальном давлении каждая молекула водорода должна сталкиваться с молекулой кислорода... более десяти миллиардов раз в секунду. Если бы любое столкновение приводило к химическому взаимодействию, реакция прошла бы быстрее взрыва — за одну десятимиллиардную долю секунды! Но мы не видим в сосуде, где смешаны два объема водорода с одним объемом кислорода, никаких изменений потому, что в обычных условиях очень редкое столкновение приводит к химической реакции. И секрет заключается в том, что сталкиваются молекулы водорода и кислорода. Прежде чем вступить в реакцию, молекулы должны распасться на атомы. Точнее говоря, валентные связи между атомами кислорода и атомами водорода в их молекулах должны ослабнуть и настолько, чтобы не препятствовать объединению разнородных атомов водорода и кислорода. Температура и играет роль кнута, подстегивающего реакцию. Она во много раз увеличивает число столкновений, делает соударения молекул более энергичными. Это приводит к ослаблению валентных связей в молекулах Н2 и O2. А когда водород и кислород получают возможность встретится на атомарном уровне, они реагируют мгновенно. Но химика-кинетика такое качественное описание процесса мало удовлетворяет. И он вводит новое понятие: энергия активации. Это та самая энергия, которой должны обладать молекулы, чтобы приобрести способность к химическому взаимодействию. Даже при обычной температуре среди молекул водорода и кислорода отыщутся такие, у которых энергия равна или больше энергии активации. Потому-то образование воды идет, но чрезвычайно медленно. Слишком мало достаточно энергичных молекул. А высокая температура приводит к тому, что активационного «барьера» достигают многие молекулы. Роль энергии активации поистине колоссальна. Вообразим себе, что все молекулы стали бы реагировать друг с другом при любых энергиях. Тогда не стоило бы даже говорить о скоростях реакции. Все вещества стали бы очень быстро соединяться друг с другом, и образовывались бы самые устойчивые соединения: окислы, соли. Все металлы моментально бы окислились, все сложные органические вещества разрушились, превратились бы в простые, но более устойчивые соединения, в том числе и вещества, входящие в состав живых клеток. Получился бы странный мир — мир без жизни, без химии, фантастический мир очень устойчивых соединений, не имеющих желания вступать в химические взаимодействия. Вот от таких неслыханных бед сберегает нас существование энергии активации. Посмотрим теперь, что такое концентрация и какую роль играет она в химических реакциях. Концентрацией называют число молекул реагирующего вещества в каком-нибудь объеме, например в кубическом сантиметре. Чем выше концентрация молекул взаимодействующих веществ, тем чаще они будут сталкиваться, тем быстрее пойдет реакция. Как же повысить концентрацию? Как «зажать» в кубический сантиметр объема побольше молекул? Вот пример. Синтез аммиака в практической деятельности человека очень важный химический процесс. Три молекулы водорода и одна молекула азота дают две молекулы аммиака: 3H2+N2→ 2NH3. Если при обычном давлении смешать три объема водорода и один объем азота, то будет всего лишь смесь газов. Но вот давление увеличивается, скажем, в 500 раз. Смесь подвергается давлению, равному 500 атмосфер. Скорость реакции увеличивается в 60 с лишним миллиардов раз. Вспомним теперь основной девиз кинетики: обеспечить полноту протекания химической реакции, получить наибольший выход нужного продукта. Если реакция идет с малым выходом продукта, то еще надо задуматься, стоит ли тратить время, силы и средства для ее осуществления. Ведь задача химии — служить человеку, служить с толком. В прошлом у химии существовал свой символ: змея, кусающая собственный хвост. Если этот образ перевести на более понятный язык современной науки, то он означает: обратимая химическая реакция. Все химические реакции в принципе обратимы. Два атома водорода и атом кислорода, соединяясь, дают молекулу воды, и одновременно другая молекула воды распадается на составные части. Две противоположные реакции протекают одновременно: образование воды (прямая реакция) и ее распад (обратная реакция). Если скорость прямой реакции равна скорости обратной, то данная система находится в равновесии. И так для любой реакции. В различных реакциях равновесие достигается в разное время: у одних мгновенно, а у других далеко не сразу. Чтобы девиз кинетики осуществился практически, нужно одно: как можно дольше оттянуть момент наступления равновесия, не допустить, чтобы обратная реакция стала конкурировать с прямой. Здесь приходится ввести еще одно очень важное для мира химических взаимодействий понятие: константа равновесия — важнейший рычаг для управления химическими реакциями. Константа равновесия реакции — это отношение произведения концентраций образовавшихся веществ к произведению концентраций веществ, первоначально вступивших в реакцию. Вот выражение для константы равновесия процесса синтеза аммиака: В числителе — концентрация образовавшегося аммиака [NH3]; так как его две молекулы, то концентрация возведена в квадрат: [NH3]•[NH3]=[NH3]2. Как «построен» знаменатель, легко догадаться. Если химик желает, чтобы та или иная химическая реакция имела практический «резонанс», он должен предварительно выяснить, чему равны значения ее константы равновесия при различных температурах. Всякая дробь тем больше, чем больше ее числитель и чем меньше знаменатель. Чем больше будет концентрация образующихся продуктов реакции, тем меньше становится концентрация исходных. Тем большим оказывается значение К. Следовательно, тем в более сильной степени прямая реакция преобладает над обратной. Вот к чему в итоге сводится задача химика — к регулировке константы равновесия. А эта регулировка требует знания двух других важнейших понятий кинетики: фактора температуры и фактора давления. Для иллюстрации главных принципов химического взаимодействия вернемся опять к синтезу аммиака. При комнатной температуре К для синтеза аммиака равна примерно 100 млн. Казалось бы, смесь азота и водорода в таких условиях моментально должна превратиться в аммиак. Но она не превращается. Очень уж мала скорость прямой реакции. А если смесь нагреть до 500°Ц? Однако в таких условиях у нас ровным счетом ничего не получится... Расчеты кинетики показывают, что при температуре 500°Ц К составляет всего-навсего... шесть тысячных (6•10-3). Во много раз преобладает обратная реакция: 2NH3→ 3H2+N2 ... А мы бы так нагревали и нагревали смесь и думали, почему у нас ничего не получается. Химическая кинетика четко доказала: для синтеза аммиака
наиболее выгодны возможно низкая температура и возможно высокое давление. И
помог кинетике в этом еще один закон, управляющий миром химических реакций, так
называемый принцип Ле Шателье, именуемый в честь открывшего его французского
ученого. Представим себе пружину, вделанную в неподвижную опору. Если оставить пружину в покое, можно сказать, что она находится в равновесии. Если сжимать ее или, наоборот, растягивать, пружина из состояния равновесия выходит. Однако одновременно начинает увеличиваться ее упругость, т. е. силы, стремящиеся вернуть ее к равновесию. Они-то и противодействуют сжатию или растяжению пружины. Наконец, наступит момент, когда обе силы уравновешиваются. Пружина снова оказывается в равновесном состоянии. Но это будет уже иное, не начальное равновесие. Оно будет смещено в сторону сжатия или растяжения. Такое поведение деформируемой пружины аналогично действию принципа Ле Шателье. Вот как его формулирует кинетика: пусть внешняя сила действует на систему, находящуюся в равновесии. Тогда равновесие смещается в сторону, указываемую этим воздействием. Смещается до тех пор, пока силы противодействия не уравняются с внешними. Опять призовем на помощь реакцию синтеза аммиака. Она, как известно, обратимая: Из четырех объемов газов получаются два. Увеличивается давление, и это приводит к уменьшению объема. Следовательно, реакция смещается вправо. «Пружина» сжимается. Выход аммиака увеличивается. Но любая реакция сопровождается выделением или поглощением тепла. При синтезе аммиака тепло выделяется: Если нагревать смесь, то реакция пойдет справа налево.
Обратная реакция будет преобладать над прямой. «Пружина» растягивается. В
обоих случаях установится новое равновесие. Но в первом оно будет
соответствовать увеличению выхода аммиака, а во втором — резкому уменьшению.
Видите, какой сложной оказывается на деле как будто бы
нехитрая реакция синтеза аммиака, как тщательно приходится подбирать наилучшие
условия температуры и давления. Но и эти факторы еще не все, чтобы можно было
говорить об успешном получении аммиака с большим выходом продукта. Теперь вернемся к стеклянному сосуду, где заключена смесь двух объемов водорода и одного объема кислорода и где не удается обнаружить ни единой капельки воды. Не нарушая герметичности сосуда, введем в него тонкую платиновую проволочку. И вот неожиданность. Проволочка нагревается, а сосуд наполняется туманом — водяными парами. Температура осталась неизменной, давление осталось таким же, а реакция, рассчитанная на тысячелетия, прошла в считанные секунды. Извлечем платиновую проволочку обратно, она совершенно не изменилась. Ее внешний вид, ее химический состав, ее вес после опыта точно такие же, какие были до опыта. Мы оказались свидетелями очень важного явления в мире химических реакций. Это явление называется катализом. А вещества, в данном случае платина, которые во много раз ускоряют реакцию, сами при этом ничуть не меняясь, именуются катализаторами. Катализаторов неисчислимое количество. Ими могут быть металлы — твердые и порошкообразные; окислы самых различных элементов; соли, основания в чистом виде и в виде смесей (см. цвет. табл.). Важнейшие процессы химической технологии, например синтез аммиака, не обходятся без катализаторов. Самое обычное металлическое железо с примесью окислов алюминия и калия значительно ускоряет эту реакцию. Химия XX в. обязана своим неслыханным расцветом именно применению катализаторов. Разнообразные жизненные процессы протекают в животных и растительных организмах благодаря специальным катализаторам — энзимам. Химия неживого и живого — вот сфера действия удивительных ускорителей. Но не всякий катализатор может ускорять данный процесс. Химики говорят, что катализаторы обладают избирательностью действия: могут активно влиять на одну реакцию, совершенно не обращая внимания на другую. Конечно, есть и исключения из этого правила. Скажем, та же окись алюминия способна катализировать несколько десятков реакций и в неорганической и в органической химии. А на синтез аммиака влияют различные катализаторы. Наконец, разные катализаторы могут заставить смесь одних и тех же веществ реагировать по-разному, давать различные продукты. Есть, оказывается, вещества не менее удивительные — промоторы. Взятые сами по себе, они равнодушно относятся к реакции. Взятые как примесь к катализатору, они ускоряют реакцию в гораздо большей степени, чем это сделал бы «одинокий» катализатор. Платиновая проволочка, «загрязненная» железом, аммиаком или двуокисью кремния, произвела бы в смеси водорода и кислорода еще более впечатляющий эффект. Почему же все-таки катализаторы ускоряют химические реакции? Как будто бы действие катализатора подобно увеличению температуры. В сосуде образуются пары воды, если нагреть его на несколько сот градусов или же внести проволочку из платины. Результат один, а достигнут он разными способами. Для того чтобы нагреть сосуд, надо привлечь энергию извне. Тепло увеличивает количество активированных молекул и константу равновесия для реакции водорода и кислорода. Катализатор не вносит никакой дополнительной энергии. Он совершенно не влияет на константу равновесия. Он лишь помогает достичь равновесия в реакции образования воды и ускоряет во много раз наступление этого равновесия. Катализатор снижает энергию активации молекул водорода и кислорода, ту энергию, которая необходима для их быстрого химического взаимодействия. Платиновая проволочка разогревается благодаря теплу, выделяющемуся при стремительно происходящем синтезе воды.   Отчего же понижается энергия активации? В присутствии катализатора реакция протекает через образование неустойчивых промежуточных соединений. Для этого требуется меньшая энергия активации. Не такая большая, как для прямого взаимодействия кислорода и водорода. Вот почему проволочка из платины и произвела в смеси водорода и кислорода столь впечатляющее действие. Есть, оказывается, кроме катализа положительного катализ отрицательный, когда присутствие катализатора не убыстряет, а, наоборот, замедляет течение реакций. Такие антикатализаторы носят название ингибиторов. Известны, например, ингибиторы коррозии. Они снижают скорость коррозии металлических изделий. Очень эффективными замедлителями коррозии считаются, в частности, соли хрома и технеция (K2CrO4, KTcO4) и множество других органических и неорганических веществ. Есть ингибиторы окисления нефтепродуктов, ингибиторы полимеризации и пр. Катализ, наконец, бывает гомогенный и гетерогенный. В первом случае и катализатор и реагирующие вещества образуют однородную систему. Окисление окиси углерода СО до углекислого газа СO2 в присутствии паров воды — вот один из примеров гомогенного катализа. При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах. Так, химическое взаимодействие между газами ускоряется твердым катализатором (синтез аммиака). Ежегодно в мире появляются сотни статей и десятки книг, посвященных изучению катализа. И многие ученые разных стран пытаются постигнуть причину каталитического действия. Одни считают, что активность катализатора зависит от его химического строения. Другие полагают, что катализ происходит в том случае, когда молекулы катализатора устроены подобно молекулам реагирующих веществ. Третьи не без основания ищут причину катализа в особых свойствах поверхности катализатора. Катализ хранит достаточно неопознанных тайн. Их хватит и на вашу долю. Студентам на лекции, посвященной химическим реакциям, демонстрируют очень впечатляющий опыт. В стеклянной колбе содержится смесь двух газов — хлора и водорода. При обычной температуре они реагируют очень медленно. Но колба почему-то упрятана под колпак из толстой проволоки. Затем лектор подносит спичку к магниевой стружке, держа ее вблизи колпака. Стружка вспыхивает ярким пламенем, происходит взрыв. Это цепная реакция взаимодействия хлора с водородом. В мире химических процессов может существовать еще один вид реакций— цепные. Если нагреть колбу до 700°Ц, она тоже взорвется. Хлор и водород соединяются мгновенно, за долю секунды. Это и не удивительно. Ведь тепло во много раз повышает энергию активации молекул. Но в опыте, о котором мы только что рассказали, температура нисколько не менялась. Эту реакцию вызвал свет. Кванты, мельчайшие «порции» света, несут большую энергию, гораздо больше той, что требуется для активирования молекулы. Вот на пути светового кванта встречается молекула хлора. Квант (hv) разделяет ее на атомы и передает им свою энергию. Атомы хлора оказываются в возбужденном, богатом энергией
состоянии (отмечены звездочками). Такие атомы обрушиваются на молекулы
водорода, разрывают их на атомы. Один из них соединяется с атомом хлора, другой
остается на свободе:
Но он возбужден. Он жаждет поделиться своей энергией с
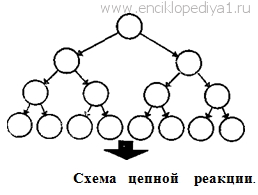
молекулой хлора. Как только он с ней сталкивается, молекуле хлора приходит конец: И опять на свободе оказывается активный хлорный атом, и он недолго ищет, куда приложить свою силу: И так получается длинная последовательная цепочка
реакций; в ней повторяются все те «шаги», которые мы только что изобразили на
бумаге. Стоит реакции начаться, как все новые и новые молекулы будут
активироваться благодаря той самой энергии, которая выделяется в результате
реакции. Скорость реакции нарастает подобно снежной лавине, несущейся с гор. Когда
лавина достигнет подножия горы, она замирает.
Цепная реакция затихает, когда все молекулы будут увлечены ею, все молекулы водорода и хлора прореагируют. Каждая активированная светом молекула Н2 или Сl2 создает около 100 000 элементарных реакций образования хлористого водорода. Химики знают множество цепных реакций. Известны цепные
реакции и физикам. Например, деление ядер урана нейтронами — пример
физической цепной реакции. Само слово «химия» стало теперь понятием собирательным, объединяющим внушительное количество научных дисциплин. Эти направления тоже изучают вещества и их превращения, но каждое направление — своими методами и способами, со своими целями и задачами. Каждое направление имеет ныне вполне самостоятельное значение. Скажем, химия и электричество нашли общие интересы. Общность интересов породила новую науку — электрохимию (см. ст. «Большая задача электрохимии»). Когда вы включаете карманный фонарик, то знайте, что
лучик света, прорезавший ночную тьму, — это результат электрохимической
реакции, которая произошла в батарейке. Вы держите в руках нержавеющую
хромированную ложку. Хромовое покрытие нанесено на стальной предмет благодаря
электрохимическому процессу — электролизу. Электрический ток выделил из раствора хромовых солей
металл и осадил его на поверхность ложки. Свет и химия, объединившись, дали начало фотохимии. Эта наука изучает химические реакции, протекающие под действием света. С ней знаком каждый, кто занимается фотографией. Пленка покрывается специальной эмульсией, в состав которой входит бромистое серебро AgBr. Под действием света его молекула распадается на атомы. Куда упало больше света, там и образовалось больше атомов серебра. Поэтому на кадре потемнения распределяются неравномерно, и эта неравномерность создает общий контур будущей фотокарточки. А вот еще один фотохимический процесс. Именно благодаря
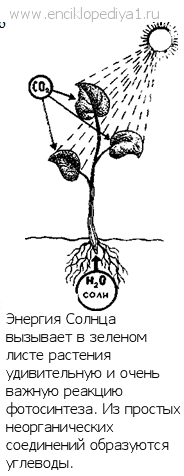
ему на Земле существует кислород, которым мы дышим. Благодаря ему на нашей
планете растет великое множество растений. Под влиянием солнечного луча в зеленом
листе из углекислого газа воздуха и воды, которую растение добывает из почвы,
ежесекундно синтезируются ценнейшие углеводы и выделяется кислород. Процесс
этот называется фотосинтезом. Каждый зеленый листочек — настоящая химическая
фабрика, где происходят тысячи сложнейших химических реакций.
Ученые еще не познали до конца процесс фотосинтеза. И, может, одна из главных задач будущей химии — изобрести искусственный «лист», в котором совершались бы те же самые процессы, что и в природе... Когда химия применила для своих нужд радиоактивные излучения, родилась ее новая область — радиационная химия. Она сразу дала заметный практический выход. Например, начало развиваться производство высококачественных пластмасс с помощью радиационно-химической полимеризации мономеров. Радиационная химия предложила новые способы вулканизации каучука. Изготовленная таким путем резина отличается большой износоустойчивостью. Или взять радиационный крекинг. Крекингом называется процесс расщепления сложных соединений, образующих нефть. При этом нефть обогащается простыми, легкими углеводородами как насыщенными, так и ненасыщенными, из которых получают многие ценные органические продукты. Обычный крекинг проводят при высокой температуре и в присутствии катализатора. Радиационный крекинг этих условий не требует. Сильное гамма-облучение образцов нефти в короткий срок производит расщепление тяжелых углеводородов. В других условиях облучение может вызвать и обратный процесс. Из легких углеводородов — метана и этана — получают сложные ценные вещества — альдегиды, кетоны и органические кислоты. Ученые ищут пути, как непосредственно из азота получить азотную кислоту под действием радиоактивных излучений. Вот они, первые достижения радиационной химии, а раскрывшиеся перед ней горизонты поистине необозримы. ... Все, что было создано на Земле до человека, все, что он создал, и все, что он создаст в будущем, — это результат химических реакций, которые так же многообразны, как сам мир. * * * Аристотель: «Наука возникла от удивления». * * * Луи де Бройль: «Наука — дочь удивления и любопытства». * * * Не забывайте немецкой пословицы: «Ганс не знает того, что не выучил Гансик». * * * Бэкон: «Человек познает в споре». Во время публичной лекции, прочитанной детям, Фарадей показывал свечу с «Роял Джорджа», которая вместе с кораблем 57 лет пролежала на дне моря. Свеча прекрасно горела |
ПОИСК
Block title
|